阿爾茨海默病新藥獲批進入中國 曾被美國《科學》雜志列為2023年度十大科學突破之一
導讀:今年1月9日,我國繼美國、日本之后,正式批準治療阿爾茨海默病的新藥侖卡奈單抗上市。這款藥曾被美國《科學》雜志列為2023年度十大科學突破...
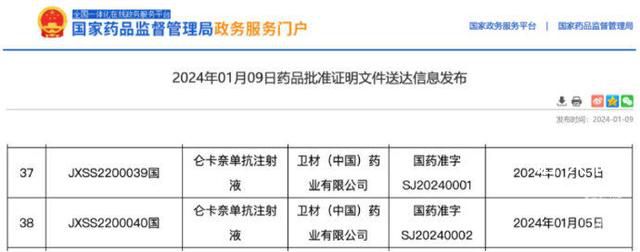
今年1月9日,我國繼美國、日本之后,正式批準治療阿爾茨海默病的新藥侖卡奈單抗上市。這款藥曾被美國《科學》雜志列為2023年度十大科學突破之一。

如何攻克阿爾茨海默病一直是醫學界的重要課題。據世界衛生組織2023年的最新統計,全世界超過5500萬人患有癡呆癥,而阿爾茨海默病(AD)是癡呆癥最常見的形式。由于人口基數大,中國的阿爾茨海默病患者在全球占比較多,約有1000萬人。面對棘手的阿爾茨海默病,人類能否研發出真正的特效藥?除了藥物,還有哪些治療方式是治愈該病的希望?我們請知名科普作者張田勘來說說這個話題。
AD新藥研發被稱為“死亡谷”
阿爾茨海默病主要表現為癡呆,即記憶、推理和社交功能的進行性損害,最終導致患者完全喪失學習記憶能力和生活能力,需要全程陪伴和護理,給家庭帶來了巨大的痛苦和負擔。僅經濟支出這一項,阿爾茨海默病每年就讓全球付出了1.3萬億美元的成本。
目前,治療阿爾茨海默病并無特效藥,臨床上采用的一些藥物只能改善癥狀,但不能有效延緩疾病進程,更談不上治愈。針對阿爾茨海默病的新藥研發也被業界公認為藥物研發的“死亡谷”,失敗率高達99.6%,其主要原因在于目前對阿爾茨海默病的病因不能完全確定。過去10年,有超過100種針對阿爾茨海默病的療法最終都歸于失敗。
2023年7月6日,美國食品藥品管理局(FDA)批準了新藥侖卡奈單抗用于治療阿爾茨海默病,患者年治療費用約需2.6萬美元。該藥由日本衛材和美國渤健藥物公司合作研發,是20年來首款獲得FDA完全批準的阿爾茨海默病新藥,且由于其對延緩病情發展有療效,被美國《科學》雜志列為2023年度十大科學突破之一。
侖卡奈單抗是一種人源化單克隆抗體(IgG1),其原理是可選擇性地與可溶性Aβ聚合物(原纖維)結合,也可與Aβ斑塊的主要成分不溶性Aβ聚合物(纖維)結合,從而清除大腦中的Aβ斑塊。雖然當下對阿爾茨海默病的病因存在爭議,但醫學界的主流觀點是β-淀粉樣蛋白(Aβ)斑塊是造成癡呆的根源之一,而且β-淀粉樣蛋白往往在有明顯癥狀出現前10-15年就開始產生并聚集。
2022年11月,《新英格蘭醫學雜志》發表了侖卡奈單抗的3期臨床試驗。對近1800名早期阿爾茨海默病患者的臨床試驗結果顯示,該藥能使阿爾茨海默病患者的認知能力下降速度減慢27%。
參試者在18個月內每兩周接受靜脈注射侖卡奈單抗或安慰劑,以了解他們的認知能力,結果顯示,侖卡奈單抗將患者病情惡化的時間推遲了大約5個月。在研究期間,接受治療的患者進展到疾病下一階段的可能性降低了31%。基于這些證據,FDA批準了該藥進入臨床。
侖卡奈單抗可有效延緩病程
雖然一些研究人員認為侖卡奈單抗的療效不理想,但仍然承認它有臨床意義,因為即使只是延緩了疾病進展,也能給阿爾茨海默病患者多一點時間,讓他們能夠獨立生活、工作得更久。侖卡奈單抗也有副作用,主要是腦腫脹和腦出血,但大多數患者服用此藥的副作用輕微或無癥狀。因此,從利大于弊的角度來看,侖卡奈單抗是有價值的。
基于這些原因,日本在美國之后于2023年9月批準侖卡奈單抗在日本使用,中國于2024年1月9日批準該藥上市,用于治療輕度阿爾茨海默病和該病引起的輕度認知障礙。
其實,獲批治療阿爾茨海默病的單抗類藥物不只是侖卡奈單抗。相對于“完全批準”的侖卡奈單抗,FDA在2021年曾“有條件”地批準了美國百健藥物公司研發的阿杜那單抗,其作用機理同樣是清除大腦中的β-淀粉樣蛋白。
但阿杜那單抗獲批后一直飽受爭議,原因在于療效不確定、有安全性問題,以及定價高昂,患者年治療費用約需5.6萬美元。其中,對阿杜那單抗的最大爭議來自療效和批準程序。提交給FDA專家小組的關于阿杜那單抗的證據有兩項隨機雙盲試驗結果,而這兩項試驗在2019年被叫停,因為它們達到了預先設定的無效標準。不過,經過收集后期數據,其中一項試驗的結果顯示阿杜那單抗優于安慰劑,有一定效果。隨后,FDA召集了11位專家來分析阿杜那單抗的有效性和安全性,有10位專家認為該藥治療阿爾茨海默病有效性的主要證據是“不合理的”,還有1位專家對此持不確定態度。意外的是,FDA最終仍然決定批準該藥上市,由此導致3名專家辭職。
除了侖卡奈單抗和阿杜那單抗之外,還有一種治療阿爾茨海默病的新藥正在等待批準,即美國禮來藥物公司研發的多奈單抗。它的原理同樣是清除β-淀粉樣蛋白,并且在試驗中展現出了較好的延緩疾病進展效果和更好的β-淀粉樣蛋白清除率。
禮來藥物公司公布的多奈單抗最新3期臨床數據,在一些方面比侖卡奈單抗還具有優勢。47%的多奈單抗使用者在用藥后12個月內沒有出現疾病進展,且這些受試者的阿爾茨海默病癥狀進展到下一個疾病階段的風險降低了39%,同時,患者的臨床認知功能衰減速度比對照組(安慰劑)受試者減緩了36%。此外,多奈單抗去除大腦中的β-淀粉樣蛋白斑塊也有明顯效果,有52%和72%的受試者在12個月和18個月完成了治療療程,他們在這兩個時間點達到了β-淀粉樣蛋白斑塊清除的標準。
不過,多奈單抗的這些數據都是基于中等Tau蛋白水平和存在中度阿爾茨海默病臨床癥狀的受試者(1182人),如果把受試對象范圍擴大,藥效就會大打折扣。目前,業界公認阿爾茨海默病的發病機制是大腦中β-淀粉樣蛋白斑塊沉積,以及細胞內過度磷酸化的Tau蛋白蓄積引起的神經纖維纏結。因此,如果加上高Tau蛋白水平患者(552人)后,多奈單抗原本35%的認知障礙緩解有效率就會下降到22%,而侖卡奈單抗在包括高Tau蛋白水平的所有受試者中,認知障礙緩解有效率都能達到29%。
多奈單抗的安全性也令人關注。多奈單抗受試者因Aβ斑塊清除而引起的腦水腫發生率為24%,比侖卡奈單抗高了11.4%;至于清除Aβ斑塊而引起的腦出血發生率,多奈單抗達到了13.6%,且在整個試驗中發生了兩起受試者因腦出血死亡的事件。
正是由于以上種種原因,對多奈單抗的審批還在觀望中。比較3種治療阿爾茨海默病的單抗(侖卡奈單抗、阿杜那單抗和多奈單抗),還是最新獲批上市的侖卡奈單抗略勝一籌。
RNA藥物有望貢獻新療法
核糖核酸(RNA)藥物和核糖核酸疫苗是未來藥物和疫苗的代表,其中信使RNA(mRNA)疫苗在抗擊2019冠狀病毒病的流行中起到了重大作用,而且獲得了2023年諾貝爾生理學或醫學獎。現在,阿爾茨海默病也可能開啟這個思路,借助RNA干擾(RNAi)療法進行治療。
RNAi療法使用RNA中兩個被稱為小干擾或沉默RNA(siRNA)的短片段,來抑制致病蛋白質,如阿爾茨海默病的β-淀粉樣蛋白。研究者用組氨酸-賴氨酸多肽來包裹siRNA物質,以確保其完整到達大腦中的靶組織——β-淀粉樣蛋白。然后,siRNA會被釋放并激活由RNA誘導沉默復合物(RISC)驅動的酶促反應,后者可以切割β-淀粉樣蛋白的mRNA鏈,阻止其在神經細胞內的表達和出現,從而緩解或治療阿爾茨海默病。
新藥侖卡奈單抗2023年7月在美國獲批上市之際,美國的艾拉倫公司正在阿姆斯特丹舉行的阿爾茨海默病協會國際會議上報告RNAi療法的1期臨床試驗早期數據,指出該療法迅速、持久地減少了阿爾茨海默病患者大腦中與疾病相關的生物標志物“淀粉樣蛋白前體蛋白”的產生。
臨床試驗招募了20名阿爾茨海默病患者進行RNAi療法A部分試驗。治療后的檢測顯示,患者腦脊液中淀粉樣蛋白前體蛋白的水平“快速持續下降”。這種蛋白會導致大腦中β-淀粉樣蛋白的過量產生,從而使淀粉樣蛋白斑塊聚集。試驗中有些患者出現了輕度到中度的不良反應,但普遍耐受良好。今年,艾拉倫公司將啟動該臨床試驗的B部分,招募更多阿爾茨海默病患者參加多劑量給藥的臨床試驗。
值得關注的是,這是第一種向中樞神經系統遞送(鞘內注射)的RNAi療法,代表了一種不同于單克隆抗體的阿爾茨海默病新療法,科學家對其未來的應用充滿期待。
電刺激與細胞移植或大有可為
如同癌癥一樣,對阿爾茨海默病也可以采用物理療法。研究者認為,采用顱內伽馬交流電刺激可以減少大腦中的β-淀粉樣蛋白。
2023年9月,中國科學院深圳先進技術研究院和美國加利福尼亞大學戴維斯分校組成了一個聯合研究團隊,采用數字建模和有限元建模,計算了顱內伽馬交流電刺激在深腦不同功能區的有效刺激電場分布和安全性評價。在確認安全性后,研究團隊對小鼠開展了為期4周的程序式顱內伽馬交流電刺激治療,結果顯示,這種療法能夠顯著減少小鼠大腦皮層和海馬區的Aβ1-42蛋白沉積,并激活小鼠皮層和海馬區的小膠質細胞,促進小鼠的學習記憶功能。
由神經元合成和分泌的蛋白質Aβ1-42是β-淀粉樣蛋白的一種形式,也是導致阿爾茨海默病的重要病原成分之一。Aβ1-42蛋白在阿爾茨海默病的病變過程中聚集成膠質斑和神經纖維纏結,損害神經元的正常功能。此外,Aβ1-42蛋白還可能在其他神經系統疾病的發病機制中發揮作用,包括創傷性腦損傷、脊髓灰質炎和肌萎縮側索硬化癥等。
兩國研究者認為,截至目前的研究結果表明:電刺激治療阿爾茨海默病具有神經生理基礎。
另外,研究人員也將治療阿爾茨海默病的突破口寄希望于移植造血干/祖細胞,這也是治療血液病、血癌等多種疾病的有效方式之一。此前有研究發現,大腦小膠質細胞中某些基因變異與阿爾茨海默病風險的增加有很大關系,其中一種基因是TREM2。TREM2原本在小膠質細胞如何檢測和處理神經變性方面發揮著重要作用,如果發生變異,就會造成小膠質細胞功能障礙,誘導大腦神經變性,從而導致阿爾茨海默病。因此,恢復有缺陷的小膠質細胞功能,可能是對抗阿爾茨海默病神經變性的一種方法。
此前,美國斯坦福大學的一個研究團隊開展了一項小鼠試驗,讓有TREM2基因缺陷的小鼠接受TREM2功能正常小鼠的造血干/祖細胞移植。結果顯示,移植后的細胞有效融入了TREM2基因缺陷小鼠大腦,成為正常的小膠質細胞,且TREM2基因缺陷小鼠原有的小膠質細胞大部分被健康細胞取代,恢復了正常的TREM2活性。最重要的是,那些過去有TREM2基因缺陷的小鼠在接受移植后,淀粉樣蛋白斑塊沉積明顯減少,其他疾病標志物也有所減少,說明TREM2基因的功能恢復能產生多種積極效應。不過,移植的造血干/祖細胞形成的小膠質細胞與小鼠大腦中的天然小膠質細胞略有不同,這也意味著,從動物試驗進入人體試驗還有一些障礙需要克服,如果按照目前的研究方法用于人類的治療,會有較高的風險。
總之,雖然電刺激和移植造血干/祖細胞用于治療阿爾茨海默病還有漫長的一段路要走,但這無疑是未來癡呆癥采用物理療法和移植療法的兩大希望。
下一篇:最后一頁
-
 阿爾茨海默病新藥獲批進入中國 曾被美國《科學》雜志列為2023年度十大科學突破之一2024-02-22 12:16:24今年1月9日,我國繼美國、日本之后,正式批準治療阿爾茨海默病的新藥侖卡奈單抗上市。這款藥曾被美國《科學》雜志列為2023年度十大科學突破
阿爾茨海默病新藥獲批進入中國 曾被美國《科學》雜志列為2023年度十大科學突破之一2024-02-22 12:16:24今年1月9日,我國繼美國、日本之后,正式批準治療阿爾茨海默病的新藥侖卡奈單抗上市。這款藥曾被美國《科學》雜志列為2023年度十大科學突破 -
 考公正在成為印度年輕人的執念 印度考公有多難?2024-02-22 12:13:51宇宙的盡頭是編制,編制的盡頭是公務員——這個鐵律在人口大國印度也成立。號稱難度世界第一的印度公務員考試(CSE)目前仍未公布最終結果,
考公正在成為印度年輕人的執念 印度考公有多難?2024-02-22 12:13:51宇宙的盡頭是編制,編制的盡頭是公務員——這個鐵律在人口大國印度也成立。號稱難度世界第一的印度公務員考試(CSE)目前仍未公布最終結果, -
 樂華為王一博報警 許凱本人已報警2024-02-22 12:11:20昨晚,許凱報警沖上熱搜第一!2月20日晚21時25分,歡娛影視發文:旗下藝人許凱先生近日被惡意造謠誹謗一事,許凱本人已報警!許凱,1995年3月
樂華為王一博報警 許凱本人已報警2024-02-22 12:11:20昨晚,許凱報警沖上熱搜第一!2月20日晚21時25分,歡娛影視發文:旗下藝人許凱先生近日被惡意造謠誹謗一事,許凱本人已報警!許凱,1995年3月 -
 吃含酵母的面食傷胃還致癌?長期食用酵母面食對人體有害?2024-02-22 12:09:45包子、饅頭、花卷應該是很多人常吃的主食之一,而想要吃起來松軟有嚼勁,最重要的步驟都是發面,也自然少不了酵母。其實不僅是面食,我們生
吃含酵母的面食傷胃還致癌?長期食用酵母面食對人體有害?2024-02-22 12:09:45包子、饅頭、花卷應該是很多人常吃的主食之一,而想要吃起來松軟有嚼勁,最重要的步驟都是發面,也自然少不了酵母。其實不僅是面食,我們生 -
 浙江麗水遭冰雹:像雞蛋大密集落下2024-02-22 11:57:132月21日夜間,浙江多地突降冰雹。在麗水青田縣,冰雹混雜著雨水,下了一地,鶴城街道菜場巷商鋪前冰雹鋪了一地,一家商鋪的老板說:下了大
浙江麗水遭冰雹:像雞蛋大密集落下2024-02-22 11:57:132月21日夜間,浙江多地突降冰雹。在麗水青田縣,冰雹混雜著雨水,下了一地,鶴城街道菜場巷商鋪前冰雹鋪了一地,一家商鋪的老板說:下了大 -
 首批Vision Pro退貨潮調查 佩戴體驗不舒適引發頭痛2024-02-22 11:56:022月16日,蘋果首款頭戴顯示設備Vision Pro的嘗鮮期到期,然而,這款被寄予厚望的創新產品卻遭遇了首批用戶的大批退貨。在各大社交平臺上,
首批Vision Pro退貨潮調查 佩戴體驗不舒適引發頭痛2024-02-22 11:56:022月16日,蘋果首款頭戴顯示設備Vision Pro的嘗鮮期到期,然而,這款被寄予厚望的創新產品卻遭遇了首批用戶的大批退貨。在各大社交平臺上, -
 蘋果智能戒指再曝光 目前已經加快了開發的進程2024-02-22 11:53:22根據報道,蘋果多年來一直醞釀推出可穿戴戒指設備的想法,并且目前已經加快了開發的進程。蘋果多年來一直都準備推出可穿戴戒指設備,這款戒
蘋果智能戒指再曝光 目前已經加快了開發的進程2024-02-22 11:53:22根據報道,蘋果多年來一直醞釀推出可穿戴戒指設備的想法,并且目前已經加快了開發的進程。蘋果多年來一直都準備推出可穿戴戒指設備,這款戒 -
 撞斷大橋涉事船主已被控制 事故原因和傷亡情況正在調查核實2024-02-22 11:52:222月22日05時30分左右,一艘集裝箱船空載從佛山南海開往廣州南沙途中,航經洪奇瀝水道時觸碰瀝心沙大橋橋墩,致橋面斷裂,事故原因和傷亡情
撞斷大橋涉事船主已被控制 事故原因和傷亡情況正在調查核實2024-02-22 11:52:222月22日05時30分左右,一艘集裝箱船空載從佛山南海開往廣州南沙途中,航經洪奇瀝水道時觸碰瀝心沙大橋橋墩,致橋面斷裂,事故原因和傷亡情 -
 官方回應出租車被指雪夜高價收費 會有相關人員進行核實處理2024-02-22 11:47:2620日,一男子發視頻稱在太原南站乘坐出租車時12公里路程被要300元車費。對此客運辦工作人員稱:會有相關人員進行核實處理。2月20日,山西太
官方回應出租車被指雪夜高價收費 會有相關人員進行核實處理2024-02-22 11:47:2620日,一男子發視頻稱在太原南站乘坐出租車時12公里路程被要300元車費。對此客運辦工作人員稱:會有相關人員進行核實處理。2月20日,山西太 -
 直擊瀝心沙大橋被撞斷現場 已實行臨時交通管制2024-02-22 11:45:152月22日05時30分左右,一艘集裝箱船空載從佛山南海開往廣州南沙途中,航經洪奇瀝水道時觸碰瀝心沙大橋橋墩,致瀝心沙大橋橋面斷裂,事故原
直擊瀝心沙大橋被撞斷現場 已實行臨時交通管制2024-02-22 11:45:152月22日05時30分左右,一艘集裝箱船空載從佛山南海開往廣州南沙途中,航經洪奇瀝水道時觸碰瀝心沙大橋橋墩,致瀝心沙大橋橋面斷裂,事故原